VetBact
Veterinärmedicinsk bakteriologi: information om betydelsefulla arter
Veterinärmedicinsk bakteriologi
Se Odlingsmedia.
Uppdaterad: 2018-05-09.
InnehållFiguren visar två BP-agarplattor. På platta A har inga bakterier odlats och på platta B har Staphylococcus aureus subsp. aureus odlats. Notera kolonierna svarta färg och att det har bildats en dubbelzon runt kolonierna. - Klicka på bilden för att förstora den.
Bild: Ingrid Hansson (SLU), Lise-Lotte Fernström (SLU) & Karl-Erik Johansson (SLU).
Baird-Parker-agar (BP-agar) är ett selektivt medium för identifiering och räkning av koagulaspositiva Staphylococcus spp. BP-agar används för detektion av Staphylococcus aureus i mat, mjölkprodukter och kosmetiska produkter. Odling görs efter ytspridning och vid 37° C.
Baird Parker agar kompletterad med acriflavin kan användas för att skilja mellan S. aureus , som kan växa i närvaro av acriflavin, och andra DNas-positiva, hemolytisk stafylokocker (S. intermedius-gruppen).
Koagulaspositiva stafylokocker bildar svarta kolonier eftersom natriumtellurit reduceras till tellurid, som är en svart olöslig substans. Lecithinas- och lipasaktivitet hos koagulaspositiva stafylokocker resulterar i en klar och en opak zon runt kolonierna.
Uppdaterad: 2018-05-09.
Innehåll
Blodagar kan användas för isolering och odling av kräsna eller icke-kräsna bakterier. Blodagarplattorna inkuberas vid olika temperaturer och i olika atmosfärer beroende på vilken bakterie det gäller.
Bakterier kan också differentieras, på basis av deras förmåga att producera hemolysiner, genom odling på blodagar. Hemolysiner är substanser (vanligen enzymer eller poriner), som har förmåga att lysera röda blodkroppar. Hemolysen kommer att ge upphov till en uppklarningszon av blodagarn runt kolonin. Bakterier kan orsaka olika typer av hemolys:
Notera att stafylokockernas α-hemolysin orsakar fullständig hemolys medan deras β-hemolysin orsakar ofullständig hemolys.
Den hemolysinproducerande förmågan kan variera mellan olika stammar av en viss bakterieart.
Uppdaterad: 2021-05-20.
InnehållFiguren visar plattor med nötblodagar med eskulin, på platta A har inga bakterier odlats. På plattorna B har Streptococcus agalactaie, odlats som inte kan hydrolysera eskulin, men växer med en kraftig beta-hemolys. Streptococcus uberis på platta C orsakar ingen hemolys men kan däremot hydrolysera eskulin vilket innebär en mörkfärgning av agarmediet. - Klicka på bilden för att förstora den.
Bild: Lise-Lotte Fernström (HBIO, SLU) och Ingrid Hansson (HBIO, SLU).
Nötblodagar med eskulin är ett agarmedium för alla vanliga juverpatogena bakterier. Nötblodagar med eskulin används framför allt vid odling av mastitprover då den kan skilja grupp D streptokocker från Streptococcus agalactae, eftersom S. agalactiae inte är kapabel att hydrolysera esculin. När eskulin hydrolyseras av bakterier bildas dextros och eskulin som reagerar med agarmediet och bildar en mörkfärgning runt bakteriekolonierna.
Mediet innehåller:
Mediets slutliga pH skall vara 7,6
Uppdaterad: 2024-11-13.
InnehållFiguren visar plattor med blåagar och på platta A har inga bakterier odlats. På plattorna B och C har en laktosfermenterare (Escherichia coli) resp. en icke-laktosfermenterar (Salmonella enterica subsp. enterica) odlats. Notera färgförändringen på grund av pH-sänkning i platta B. - Klicka på bilden för att förstora den.
Bild: Karl-Erik Johansson (BVF, SLU) och Lise-Lotte Fernström (BVF, SLU).
Blåagar med laktos används ofta för detektion och typning av medlemmar av familjen Enterobacteriaceae, därför att det kan användas för att skilja på laktosefermenterare och icke-laktosfermenterare. MacConkey-agar används på en del laboratorier istället för blåagar (med laktos).
Mediets pH skall vara 6,8 och vid detta pH är bromkresolpurpur lila. Laktos-fermenterande bakterier sänker pH på mediet, som blir surt och det ändrar då färg från blå-lila to gult. Laktos kan ersättas med t.ex. maltos eller trehalos för att bestämma om en viss bakterie kan fermentera dessa kolhydrater. Dessa modifierade media används för andra bakterier än medlemmar av familjen Enterobacteriaceae, t.ex. medlemmar av släktet Staphylococcus.
Uppdaterad: 2018-05-09.
InnehållBild A visar en en platta innehållande Brilliance™ Listeria Agar före odling. Bild B visar samma sorts platta på vilken Listeria monocytogenes har odlats vid 37°C under 48 timmar. Observera den ovanliga färgen på kolonierna och den grumliga zonen, som bildas runt dessa kolonier. Klicka på bilden för en förstoring (visas i nytt fönster/flik).
Bild: Karl-Erik Johansson (BVF, SLU) och Lise-Lotte Fernström (BVF, SLU).
Brilliance™ Listeria Agar från Oxoid kallades tidigare Oxoid Chromogenic Listeria Agar (OCLA) och det är ett odlingsmedium, som används för isolering, räkning och preliminär identifiering av Listeria spp. och Listeria monocytogenes, som har isolerats från livsmedelsprover.
Mediets slutliga pH skall vara 7,2.
Mediet ska sedan blandas med två olika supplementlösningar. Den ena lösningen innehåller antibiotika (nalidixinsyra, polymyxin B, ceftazidim och amfotericin). Den andra lösningen innehåller lecithin.
Medlemmar av släktet Listeria har ett β-glukosidas, som klyver X-glukosiden till en blågrön produkt. Andra bakterier, som har ett β-glukosidas inhiberas av de antibiotika, som finns i mediet. L. monocytogenes och patogena stammar av Listeria ivanovii har ett lecithinas, som spjälkar lecithin till fosfokolin och en diglycerid. Diglyceriden är olöslig och om bakterien, som odlas på Brilliance Listeria Agar, har ett lecithinas, så bildas det en grumlig zon runt kolonierna på grund av utfälld diglycerid.
Uppdaterad: 2018-05-09.
InnehållFiguren visar tre BG-agarplattor. Inga bakterier har odlats på plattan i bild A. På plattan i bild B har Escherichia coli odlats och på platta C har Salmonella sp. odlats. Notera att färgen på platta A har slagit om från gulröd till gul där kolonier växer och att kolonierna ser gulaktiga ut. På platta C har färgen slagit om till mörkröd och kolonierna till rosa. E. coli växer dåligt på BG agar. - Klicka på bilden för att förstora den.
Bild: Karl-Erik Johansson (BVF, SLU) och Lise-Lotte Fernström (BVF, SLU).
Brilliant Grön (BG) Agar används för selektiv isolering av Salmonella spp.
Digererat kasein och djurvävnad utgör källan för kväve, aminosyror och kol. Jästextraktet innehåller vitaminer, som krävs för bakterieväxt. NaCl ger mediet dess osmotiska balans. Laktos och sukros utgör mediets kolhydrater. Brilliantgrönt inhiberar grampositiva bakterier och de flesta gramnegativa stavar utom Salmonella spp. Mediets pH är 6,9. Fenolrött är pH-indikator, som blir gult när pH sjunker på grund av fermentation av laktos och/eller sukros. Agar gör att mediet stelnar.
Övriga kommentarer:
Uppdaterad: 2024-03-17.
Innehåll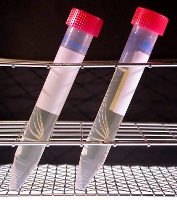
BPV innehåller pepton, NaCl, Na2HPO4.12H2O, KH2PO4 och vatten.
Pepton kommer från mjölk eller kött, som har digererats med ett proteolytiskt enzym. Pepton utgör källan för kol, kväve, vitaminer och mineraler i BPV. Natriumklorid ger osmotisk balans och mediet är buffrat med fosfat (pH = 7.2).
Uppdaterad: 2019-09-25.
InnehållFiguren visar två CCDA-plattor. Inget prov har applicerats på plattan i bild A. På plattan i bild B har ett prov med Campylobacter jejuni subsp. jejuni odlats. Kolonierna ser gråvita ut och lutar man plattan och håller den i ljuset från en lampa får kolonierna ett metalliskt sken, vilket kan ses på CCDA-plattan på C. jejuni subsp. jejuni-sidan. - Klicka på bilden för att förstora den.
Bild: Karl-Erik Johansson (BVF, SLU) och Lise-Lotte Fernström (BVF, SLU).
Mediet, som beskrivs här är egentligen ett modifierat CCDA-medium, ett blodfritt selektivt medium för isolering av Campylobacter spp. Odling på CCDA-plattor görs vid 37 eller 42°C efter ytspridning och inkubering under microaerofil atmosfär i närvaro av CO2.
Mediets slutliga pH skall vara 7,4.
Kolonier av Campylobacter spp. är plata och runda till oregelbundna med jämna kanter. På CCDA är koloniena ofta halvgenomskinliga och gråvita med metallglans. Kolonier av vissa stammar kan svärma, framförallt på fuktig agar.
Uppdaterad: 2019-10-09.
InnehållCIN- (Cefsulodin-Irgasan-Novobiocin) agar är ett selektivt differentialmedium, som används i kvalitativa procedurer för isolering av Yersinia enterocolitica från olika typer av kliniskt material. Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis, Pseudomonas aeruginosa, Salmonella enterica, Shigella sonnei och Streptococcus faecalis växer ej på CIN-agar. Genom att minska koncentrationen av cefsulodin, kan CIN-agar också användas för selektiv isolering av Aeromonas spp.
Detta odlingsmedium skall ha ett slutligt pH på 7,4.
Differentiering av bakterier är baserad på fermentation av mannitol. Organismer, som kan fermentera mannitol kommer att sänka pH runt kolonierna och neutralrött kommer att ändra färg så att kolonierna ser röda ut. På grund av den lokala pH-sänkningen kan en zon av utfällda gallsalter observeras. Kolonins utseende brukar liknas vid ett tjuröga ("bull's eye"). Organismer, som inte metaboliserar mannitol till syra, bildar färglösa genomskinliga kolonier.
Uppdaterad: 2018-05-09.
InnehållFiguren visar CLED-agarplattor där inga bakterier har odlats på platta A. På plattorna B och C har Proteus vulgaris resp. Escherichia coli odlats. Notera färgomslaget på platta C där E. coli har odlats. Proteus spp. svärmar normalt inte på CLED agar, men om kolonierna ligger mycket tätt och om plattan har inkuberats lite för länge, så kan svärmning uppkomma, vilket syns inom vissa områden av platta B. På platta D har Staphylococcus pseudintermedius odlats. - Klicka på bilden för att förstora den.
Bild: Karl-Erik Johansson (BVF, SLU) and Lise-Lotte Fernström (BVF, SLU).
Cysteine Lactose Electrolyte Deficient (CLED-) agar är ett icke-inhiberande tillväxtmedium för isolering och differentiering av bakterier, som orsakar urinvägsinfektioner. Eftersom CLED-agar inte innehåller elektrolyter (salter) kan det användas för att förhindra Proteus spp. att svärma.
Mediets slutliga pH skall vara 7,3.
Laktosfermenterare bildar kolonier, som ser gula ut, på CLED agar medan bakterier, som inte fermenterar laktos bildar kolonier, som ser blå ut.
E. coli bildar kolonier, som ser gulaktiga ut, eftersom agarn blir gulaktig.
Proteus spp. bildar kolonier, som ser blåaktiga ut eftersom agarn inte ändrar färg.
Klebsiella spp. bildar extremt mukoida kolonier. Dessa kolonier kan variera i färg från att se gulaktiga ut till ljusblåaktiga. Agarn ändrar färg och blir gulaktig.
Uppdaterad: 2019-09-05.
InnehållFiguren visar i första kolumnen (A, C och E) den sida av droppglaset (Uricult), som täcks av E. coli-agar till vänster och MacConkey-agar till höger. I den andra kolumnen (B, D och F) visas den andra sidan av droppglaset, som täcks av CLED-agar. I första raden (A och B) har inga bakterier applicerats. I andra raden (C och D) har Escherichia coli applicerats. I tredje raden (E och F) har Proteus vulgaris applicerats. - Klicka på bilden för att förstora den.
Bild: Karl-Erik Johansson (BVF, SLU) och Lise-Lotte Fernström (BVF, SLU).
Doppglas är ett analyssystem, för att påvisa mikrorganismer i vätskor. Systemet består av en tätslutande plastburk innehållande ett objektglas med agarbaserade odlingsmedier på en eller två sidor. Objektglaset doppas i den vätska, som ska analyseras. Man kan också flöda vätskan över objektglaset med en pasteurpipett. Sedan sätts glaset tillbaka i ursprungsbehållaren och inkuberas vid lämplig temperatur under 1-2 dygn. Därefter avläses resultatet. Det finns system utvecklade för olika applikationer. Inom veterinär- och humanmedicin används doppglas ofta för analys av urinprover.
Det finns flera kommersiella system utvecklade för urinprover och inom veterinärmedicin används ofta Uricult® Trio i Sverige (se figur). I detta system har man CLED-agar på hela ena sidan och på den andra sidan har man MacConkey-agar på ena halvan och E. coli-agar på andra halvan. På CLED-agar växer de flesta urinvägspatogener och om de är laktosfermenterande så ändrar CLED-agarn färg från grönt till gult. På MacConkey-agar växer framför allt gramnegativa bakterier. På E. coli-agar bildar E. coli-stammar, som producerar β-glukoronidas, grå-brun till brun-svarta kolonier. Andra bakterier som växer ger inget färgomslag i kolonierna.
Uppdaterad: 2018-05-09.
InnehållFiguren visar en FAA-platta på vilken bakterier ej har odlats. Observera färgen, som är mörkare än på vanliga blodagarplattor - Klicka på bilden för att förstora den.
Bild: Karl-Erik Johansson (BVF, SLU) och Lise-Lotte Fernström (BVF, SLU)
Fastidious anaerobic agar (FAA-plattor) används för odling av kliniskt viktiga anaeroba bakterier under syrefria betingelser.
Observera att även fakultativt anaeroba bakterier växer på dessa plattor, men inte så bra som på vanliga blodagarplattor.
Uppdaterad: 2018-05-09.
InnehållFiguren visar en hematinagarplatta på vilken bakterier ej har odlats. Observera färgen, som är brunare än på vanliga blodagarplattor eller FAA-plattor. - Klicka på bilden för att förstora den.
Bild: Karl-Erik Johansson (BVF, SLU) och Lise-Lotte Fernström (BVF, SLU).
Hematinagar, som också kallas chokladagar, är ett icke-selektivt anrikningsmedium. Detta medium används för isolering av kräsna bakterier, som t.ex. Haemophilus spp. och Taylorella equigenitalis..
Mediets pH skall vara 6,8. Hematinagar har i princip samma sammansättning som blodagar, men hematinagar upphettas i ett kokande vattenbad under i timme tills färgen har ändrats från röd till chokladbrun.
När blodet har upphettats enlig ovan har de röda blodkropparna lyserat och släppt ut hemin (X-faktor) och NAD (V-faktor), som är nödvändiga näringsämnen för vissa bakterier. Namnet chokladagar syftar på mediets färg och inte på dess innehåll. Hemolys kan inte observeras på hematinagar. Genom att göra vissa tillsatser kan mediet göras selektivt.
Uppdaterad: 2018-05-09.
InnehållFiguren visar en COBA-platta, på vilken Streptococcus equi subsp. zooepidemicus, som ger β-hemolys, har odlats. Plattan visas med belysning ovanifrån (A) och underifrån (B). - Klicka på bilden för att förstora den.
Kolistin-Oxolinsyra-BlodAgar (COBA) är ett selektivt medium, som används för isolering av streptokocker. Mediet innehåller antibiotika, som inhiberar växt av bl.a gramnegativa bakterier.
COBA är ett blodagarbaserat medium, som innehåller kolistinsulfat och oxolinsyra.
De flesta streptokockarter inhiberas ej av kolistinsulfat och oxolinsyra, medan medlemmar av familjen Enterobacteriace, Pseudomonas aeruginosa, stafylokocker och korynebakterier inhiberas.
Uppdaterad: 2019-05-28.
InnehållFiguren visar Krom-agarplattor med cefotaxime där inga bakterier har odlats på platta A. På platta B har Escherichia coli (till vänster) och Enterococcus spp. (till höger) odlats. Plattorna C och D är prov från faeces från kalv där det finns en blandflora med. Notera färgskillnader, E. coli växer med mörkrosa färg och Enterococcus sp. är turkosa. Växten av bakterier på dessa plattor visar att de är ESBL producerande och alltså resistenta mot carbapanemer eftersom cefatoxim har tillsats i agarn. Bilderna är tagna med ljus underifrån - Klicka på bilden för att förstora den.
Bild: Ingrid Hansson (SLU), Lise-Lotte Fernström (SLU) & Karl-Erik Johansson (SLU).
Kromogena substrat av olika fabrikat underlättar odlingen och identifiering av bakterier då specifika bakterier växer med olika distinkta kolonifärger. Det finns olika varianter av kromagar som kan användas för odling och eventuellt differentiering av t ex :
Mediets slutliga pH brukar vara 7,0.
Bakteriekolonierna har olika utseende på agarn, nedan finns några exempel
| Bakterie genus eller species | Koloniutseende |
|---|---|
| Citrobacter, Enterobacter, Klebsiella, Serratia | blå metallisk med eller utan rödaktig halo |
| E. coli | mörk rosa till röd |
| Enterococcus | turkos |
|
Morganella, Proteus, Providencia |
brun halo |
| Psudomonas | genomskinlig, krämig grönaktig |
| S. aureus | guldaktig, lätt genomskinlig |
Uppdaterad: 2019-10-24.
InnehållBilden visar tre plattor med MacConkey-agar. På plattan i bild A har inga bakterier odlats. På plattorna i bilderna B och C har Escherichia coli resp. Proteus vulgaris odlats under inkubering vid 37 °C. Observera färgen på kolonierna, precipitationszonen på plattan i bild B och att P. vulgaris inte svärmar på plattan i bild C, som inte innehåller NaCl. - Klicka på bilden för att förstora den.
Bild: Karl-Erik Johansson (BVF, SLU) och Lise-Lotte Fernström (BVF, SLU)
MacConkey-agar är ett selektivt odlingsmedium, som används för att odla gramnegativa bakterier och för att skilja på sådana som fermenterar och de som inte fermenterar laktos. Detta medium har visat sig vara användbart för identifiering av tarmbakterier. Blåagar (med laktos) används på en del laboratorier istället för MacConkey-agar.
Slutligt pH på mediet skall vara ca. 7,1. Det finns många varianter av MacConkey agar och t.ex. NaCl kan uteslutas om man inte vill att Proteus spp. ska svärma. Gallsalter och kristallviolet inhiberar de flesta grampositiva bakterier. Neutralrött är färglöst vid pH som är högre än 6,8 och slår om till rött vid pH under 6,8.
Uppdaterad: 2021-10-10.
InnehållFiguren visar MYP-agarplattor. Platta A är kontroll och saknar bakterier. På platta B har 5 misstänkta kolonier av B. cereus odlats. Runt utstryken av bakterier, ser man en utfällning beroende på att lecithin spjälkas till bl.a. en diglycerid, som är olöslig. För en jämförelse har Staphylococcus aureus subsp. aureus (t.v.) och B. cereus (t.h.) odlats på platta C. Det bildas ingen utfällning runt utstryket av S. aureus subsp. aureus och dessutom ser man att S. aureus subsp. aureus kan fermentera manitol. - Klicka på bilden för att förstora den.
Bild: Ingrid Hansson (SLU), Lise-Lotte Fernström (SLU) & Karl-Erik Johansson (SLU).
Mannitol egg Yolk Polymyxin agar (MYP-agar) är ett selektivt medium för identifiering och räkning av Bacillus cereus i livsmedelsprover. MYP-agar kallas också MCS- (Mossel Cereus Selektiv) agar eller BCS- (Bacillus Cereus Selektiv) agar. MYP-agar innehåller mannitol, som B. cereus ej fermenterar och äggula, som i sin tur innehåller lecithin, vilket kan spjälkas av det fosfolipas C, som finns i B. cereus. Dessutom innehåller MYP-agar polymyxin, som inhiberar gramnegativa bakterier.
Mediets slutliga pH skall vara 7,2. Äggula och polymyxin tillsätts aseptiskt när mediet är steriliserat.
Om B. cereus växer på MYP-agar så bildas det en utfällning runt kolonier eller strecket, och man får inte någon gulfärgning eftersom B. cereus ej fermenterar mannitol och det inte blir någon pH-sänkning runt kolonier eller strecket.
Uppdaterad: 2023-05-03.
InnehållFiguren visar fyra MSRV-agarplattor. Bakterier har ej odlats på plattan i bild A. På plattan i bild B har en bakterie, som inte är Salmonella sp. applicerats. På plattorna i bilderna C och D har Salmonella enterica subsp. enterica applicerats. Plattorna i bilderna B och D har inkuberats under 48 timmar vid 41,5 °C och plattan i bild C har inkuberats under 24 timmar vid samma temperatur. Notera att den blå färgen på platta C är helt försvunnen efter 48 timmar (platta D) på grund av att Salmonella spp. svärmar ut över agarn och bildar ett grått kontinuerligt lager.
Bild: Karl-Erik Johansson, Ingrid Hansson och Lise-Lotte Fernström (BVF, SLU). - Klicka på bilden för att förstora den.
Modified Semisolid Rappaport Vassiliadis (MSRV) -agar är ett selektivt anrikningsmedium för snabb detektion av rörliga Salmonella spp. i feces och livsmedelsprodukter. När MSRV-agarplattan används appliceras 100 µl prov fördelat på tre ställen (se bilden).
Skillnaden mellan RVS-medium och MSRV-medium är att MRSV-mediet innehåller en låg koncentration av agar, som gör att rörliga stammar av Salmonella spp. svärmar till skillnad från de flesta andra rörliga bakterier. De flesta Salmonella-stammar är rörliga. Dessutom innehåller MSRV-mediet Novobiocin, som ökar selektiviteten
Runt ett salmonella-negativt prov bildas ingen kraftig gråaktig svärmningszon, medan salmonella-positiva prover ger mycket kraftig svärmning, som täcker hela plattan efter 1-2 dygn.
Uppdaterad: 2020-08-18.
InnehållFör att kunna isolera, identifiera eller karaktärisera bakterier behöver man ofta (men inte alltid) föröka dem genom odling och för detta ändamål används flytande eller fasta media (substrat). Medier kan vara definierade eller odefinierade. I ett definierat medium känner man till alla komponenter som ingår, medan ett odefinierat (eller semidefinierat) medium kan innehålla olika typer av kommersiella extrakt från växt- eller djurvävnad där man inte vet exakt vilka näringsämnen som ingår. Dessutom kan sammansättningen variera från batch till batch. Ett minimalmedium innehåller bara de substanser, som är absolut essentiella för att en viss bakterie ska kunna växa. Ett rikt medium innehåller dessutom många substanser (t.ex. serum, aminosyror och nukleotider samt vitaminer), som gör att bakterien i fråga växer snabbare och rikligare.
Flytande media är sterila näringslösningar, som är anpassade efter de bakterier man vill kunna odla. Ett anrikningsmedium är ett flytande medium, som är speciellt anpassat till en viss bakterieart eller en grupp av närbesläktade bakteriearter. Anrikningsmedia används för att man ska vara säker på att en viss bakterie kommer att växa, även om den i ursprungsprovet föreligger i en liten mängd. Vid vissa odlingar t ex Salmonella analys används preanrikning, för att stimulera tillväxten av samtliga bakterier i provet. Preanrikningen är alltså ett icke selektivt anrikningsmedium, vid analys av Salmonella används den innan den selektiva anrikningen. Selektiva medier kan vara flytande, halvfasta eller fasta och de innehåller substanser (t.ex. antibiotika eller andra bakterieinhiberande substanser), som gör att vissa bakterier inte kan växa. Selektiva medier används för att öka chanserna att kunna odla fram en långsamväxande bakterie, som annars lätt konkurreras ut.
För att få fasta substrat tillsätter man en gelbildande substans till ett flytande medium och värmer blandning tills substansen löser sig. Därefter kyls lösningen tills den stelnar. Agar är den vanligaste gelbildande substansen, men även agaros kan användas, vilken renas fram ur agar. I vissa speciella odlingar (t.ex. av mykobakterier) används äggula, som gelbildare. Halvfasta media tillverkas genom att använda en mindre mängd gelbildare.
För att underlätta identifiering av bakterier, så tillsätter man ofta en pH-indikator till odlingsmediet för att se om bakterien producerar metaboliter, som förändrar mediets pH. När man tillsätter en pH-indikator till att fast medium och bakterien i fråga producerar en metabolit, som förändrar mediets pH och man därmed får ett färgomslag, så kan det se ut som om kolonierna också ändrar färg. Det är dock oftast bara mediet, som ändrar färg, men kolonier är ofta genomskinliga eller halvgenomskinliga och därför kan det se ut som om de ändrar färg.
Det finns andra mer specifika tillsatser, som också används för identifiering och som leder till en kemisk reaktion i bakterien eller på bakteriens yta där man verkligen kan säga att kolonin har ändrat färg. T.ex. tellurit i Baird-Parker-agar och X-glukosid i Brillians-Listeria-agarmedium.
Uppdaterad: 2020-01-20.
InnehållFiguren visar fyra PC-agarplattor. Bakterier har ej odlats på platta A. På platta B växer det 4 kolonier, platta C 45 kolonier och på platta D >250 kolonier. Plattorna på bilderna B, C och D är från samma prov som spätts i en tiofaldig spädningsserie och därefter djupspridits. Plattorna har inkuberats under 72 timmar vid 30° C
- Klicka på bilden för att förstora den.
Bild: Ingrid Hansson, Lise-Lotte Fernström och Karl-Erik Johansson (BVF,SLU)
"Plate count agar" (PCA) eller "Standard PCA" är ett bakteriologiskt substrat, som används för att bestämma det totala antalet levande, aeroba bakterier i ett prov. PCA är alltså inte ett selektivt medium. Mängden bakterier uttrycks som kolonibildande enheter (colony forming units) per gram (CFU/g) om det är ett fast prov och per ml (CFU/ml) om det är ett flytande prov. Detta värde bestäms genom att man gör en tiofaldig spädningsserie. Därefter tas 1 ml från varje spädning, som stryks ut på plattorna och en djupspridning görs genom att 10-15 ml PCA hälls över. Plattorna inkuberas sedan vid 20 eller 30° C i tre dygn. Efter inkubering räknas antalet kolonier på den agarplatta som har 25-250 kolonier, vilket anses ge det mest tillförlitliga resultatet. När man sedan beräknar det faktiska bakterieinnehållet i provet måste man givetvis ta hänsyn till spädningsfaktorn.
Slutligt pH på mediet skall vara 7,0.
Mediet är halmfärgat (blekt gulbrunt), vilket gör att eventulla kolonier också ser halmfärgade ut.
Uppdaterad: 2018-05-09.
Innehåll
RVS-medium innehåller: Soja-pepton MgCl2, NaCl fosfat malakitgrönt Slutligt pH ska vara 5.2.
Mediets selektivitet beror på närvaron av malakitgrönt, högt osmotiskt tryck, och lågt pH. Hög koncentration av magnesium klorid ökar det osmotiska trycket, och i kombination med malakitgrönt, inhiberas andra bakterier än Salmonella spp. Mediets låga pH ökar selektiviteten genom att inhibera den medföljande bakteriefloran, inkluderande tarmbakterier.
Uppdaterad: 2012-12-04.
InnehållUppdaterad: 2013-02-06.
InnehållFiguren visar två olika SELMA PLUS-plattor under två olika ljusbetingelser. Bakterier har ej odlats på plattorna A och B, men på plattorna C och D har Escherichia coli odlats. Plattorna A och C fotograferades med en mörk bakgrund och med ljus ovanifrån. Plattorna B och D fotograferades med ljus underifrån. - Klicka på bilden för att förstora den.
Bild: Karl-Erik Johansson (SLU), Ingrid Hansson (BVF) och Lise-Lotte Fernström (BVF, SLU).
SELMA-plattor används för att identifiera bakterier, som kan orsaka mastit, och skall enbart användas för mjölkprover. SELMA betyder SELective MAstitis medium och det finns två varianter av SELMA plattor. SELMA, som har tre sektorer och SELMA PLUS som har fyra sektorer med olika odlingsmedia. På denna sida visas endast SELMA PLUS-plattor och sektorerna är numrerade i plattans botten.
Notera att E. coli växer på alla media utom mannitolsaltagar. Notera också färgomslaget från blått till grönt i PGUA-agarn på grund av att E. coli har ett β-glukoronidas och färgomslaget i MacConkey-agarn runt kolonierna på grund av ett sänkt pH.
För mer information, se SVAs webbplats, och "Användarinstruktion: Selma & Selma Plus", där plattorna observeras ovanifrån.
Uppdaterad: 2018-05-09.
InnehållFiguren visar två olika SELMA-plattor under två olika ljusbetingelser. Bakterier har ej odlats på plattorna A och B, men på plattorna C och D har Staphylococcus aureus subsp. aureus odlats. Plattorna A och C fotograferades med en mörk bakgrund och med ljus ovanifrån. Plattorna B och D fotograferades med ljus underifrån. - Klicka på bilden för att förstora den.
Bild: Karl-Erik Johansson (SLU), Ingrid Hansson (BVF) och Lise-Lotte Fernström (BVF, SLU).
SELMA-plattor används för att identifiera bakterier, som kan orsaka mastit, och skall enbart användas för mjölkprover. SELMA betyder SELective MAstitis medium och det finns två varianter av SELMA plattor. SELMA, som har tre sektorer och SELMA PLUS som har fyra sektorer med olika odlingsmedia. På denna sida visas endast SELMA-plattor och sektorerna är numrerade i plattans botten.
För mer information, se SVAs webbplats, "Användarinstruktion: Selma & Selma Plus", där plattorna observeras ovanifrån.
Uppdaterad: 2018-05-09.
InnehållFiguren visar plattor med SlaBa-agar. På platta A har inga bakterier odlats och på platta B har Enterococcus faecalis odlats. Observera färgen på kolonierna.- Klicka på bilden för att förstora den.
Bild: Karl-Erik Johansson (BVF, SLU) och Lise-Lotte Fernström (BVF, SLU).
Slanetz och Bartley-agar (SlaBa-agar) är ett selektivt medium, som används för ytspridning och räkning av Enterococcus spp. i dricksvatten, drycker och andra biologiska produkter med animalt ursprung. Odling på SlaBa-agar görs vid 44° C efter ytspridning.
Mediets slutliga pH skall vara 7,2.
När bakterier växer reduceras TTK till en produkt, som kallas formazan och detta gör att kolonierna blir röda till rödbruna.
Uppdaterad: 2018-05-09.
InnehållFiguren visar agarplattor med Smith-Baskerville-medium där inga bakterier har odlats på platta A. På platta B har Bordetella bronchiseptica odlats. Observera att färgen på mediet slår om till blått eftersom B. bronchiseptica är aerob och inte fermenterar kolhydrater. Mediet blir alltså alkaliskt när denna bakterie växer på plattan. På den övre delen av plattan finns det inte tillräckligt många bakteriekolonier för att färgen ska slå om till blått. - Klicka på bilden för att förstora den.
Bild: Karl-Erik Johansson (BVF, SLU) och Lise-Lotte Fernström (BVF, SLU)
Smith-Baskerville (S-B) är ett selektivt odlingsmedium för Bordetella bronchiseptica.
Mediets slutliga pH skall vara 6.8 vid vilket bromotymolblått är grönt. Mediet blir blått vid alkaliskt pH.
Uppdaterad: 2018-05-09.
InnehållBilden visar en kombinerad TSA och VRG-agarplatta. På platta A har inga bakterier strukits ut, medan Escherichia coli har strukits ut på platta B. - Klicka på bilden för att förstora den.
"Tryptic soy agar (TSA)" ett generellt medium, som används för isolering och räkning av en mängd olika bakterier, bl.a. E. coli.
Mediets slutliga pH skall vara 7,3.
TSA används ofta i kombination med VRG-agar. TSA blandas då med provet, som ska analyseras, vid ca. 40° C och blandningen hälls sedan i plattan. Efter förinkubering under 1-2 tim. vid rumstemperatur, gjuts ett lager av VRG-agar ovanpå och inkuberingen får fortsätta vid 37°C.
Uppdaterad: 2023-05-31.
InnehållFiguren visar tre TSC-agarplattor och på platta A har inga bakterier odlats. På platta B och C har Clostridium perfringens odlats. Platta C innehåller lecithin, vilket inte platta B gör. Notera precipitatationszonen av diglycerider runt kolonierna på platta C. - Klicka på bilden för att förstora den.
Bild: Ingrid Hansson (SLU), Lise-Lotte Fernström (SLU) & Karl-Erik Johansson (SLU).
Tryptos Sulfit Cykloserin-agar (TSC-agar) används för isolering och räkning av både vegetativa celler och sporer av Clostridium perfringens i livsmedel och kliniska prover.
Mediets slutliga pH skall vara 7,6.
Vätesulfidpositiva (H2S-positiva) bakterier (som t.ex. C. perfringens) bildar svarta kolonier på TSC-agar. Om TSC-agarn innehåller lecithin, får man precipitationszoner runt bakteriekolonier, som producerar lecithinas.
Uppdaterad: 2019-06-11.
InnehållFiguren visar en VRG-agarplatta på vilken kolifoma bakterier har odlats. - Klicka på bilden för att förstora den.
Bild: Ingrid Hansson (SLU), Lise-Lotte Fernström (SLU) & Karl-Erik Johansson (SLU).
Violettrött-gallagar (VRG-agar) är ett selektivt medium, som används för detektion och räkning av koliforma bakterier i vatten, mjölk och andra mjölkprodukter.
Mediets slutliga pH skall vara 7,4.
VRG-agar används ofta i kombination med TSA (Tryptone Soya Agar) för detektion och räkning av termotoleranta koliforma bakterier (inklusive E. coli). Ett tunt lager TSA (innehållande bakterieprovet) gjuts då i botten av plattan, som sedan inkuberas under 1-2 tim. i rumstemperatur. Därefter gjuter men på ett lager av VRG-agar och plattan inkuberas vidare.
Uppdaterad: 2023-05-31.
InnehållFiguren visar tre VRGG-agarplattor. Bakterier har inte odlats på plattan i bild A. Två olika medlemmar av familjen Enterobacteriaceae har odlats vid 37 °C under 24 timmar på plattorna B och C. Runt kolonierna kan man ana halon som bildas på grund av utfällda gallsalter, vilket också gör att kolonierna ser oskarpa ut. Detta är speciellt tydligt på plattan i bild C.
Bild: Karl-Erik Johansson (BVF, SLU) och Lise-Lotte Fernström (BVF, SLU).
Violettrött-gallglukosagar (VRGG-agar), som är ett selektivt medium, används för isolering och räkning av medlemmar av familjen Enterobacteriaceae i livsmedel.
Mediets slutliga pH skall vara 7,4.
Medlemmar av familjen Enterobacteriaceae bildar små (1-2 mm i diameter), runda och violetta till skära kolonier med en halo på VRGG-agar. Det finns några andra släkten, som också växer på VRGG-agar, t.ex. Aeromonas. Därför måste koloniernas identitet konfirmeras med någon oberoende metod, t.ex. oxidastest.
Uppdaterad: 2023-05-31.
InnehållFiguren visar tre XLD-agarplattor. Inga bakterier har odlats på plattan i bild A. På plattan i bild B har Salmonella sp. odlats. Notera att kolonierna är rosa med svart centrum. På plattan i bild C har Escherichia coli odlats. Notera färgomslaget i den övre delen av plattan, där E. coli- (laktosfermenterare), kolonier uppträder. - Klicka på bilden för att förstora den.
Bild: Karl-Erik Johansson (BVF, SLU) och Lise-Lotte Fernström (BVF, SLU).
Xylos lysin deoxycholatagar (XLD-agar) är ett selektivt odlingsmedium, som används för isolering av Salmonella spp. och Shigella spp. från kliniska prover och från livsmedelsprover. XLD-agar håller pH 7,4 och innehåller indikatorn metylrött, som ger en röd eller skär färg.
Många tarmbakterier (utom Shigella spp.) fermenterar xylos under syrabildning. Dessa bakterier bildar därför gula kolonier på XLD agar, men Salmonella spp. dekarboxylerar lysin, vilket höjer pH och därför förblir kolonierna röda. Dessutom producerar Salmonella spp. vätesulfid (H2S) från tiosulfat vilket ger en svart fällning med järnsalter.
Övriga kommentarer:
Uppdaterad: 2019-09-25.
Innehåll